Ein Kooperationsprojekt des Barrett-Initiative e.V. und des Universitätsklinikums Leipzig
Ein Kooperationsprojekt des Barrett-Initiative e.V. und des Universitätsklinikums Leipzig
Liebe Patientinnen, Liebe Patienten,
unter diesem Reiter finden Sie einige Informationen zum Thema „Barrett-Ösophagus bzw. -karzinom“, welche Ihnen einen ersten Überblick über das Erkrankungsbild geben sollen. Diese – und viele weitere spannende Themen – werden in unseren Webcast-Veranstaltungen vertieft und von unseren Spezialistinnen und Spezialisten aus verschiedenen Fachdisziplinen erklärt.
Obschon bösartige Tumorerkrankungen der Speiseröhre eher zu den selteneren Entitäten gehören, erhalten jährlich etwa 6.100 Männer und 1.800 Frauen in Deutschland diese lebensverändernde Diagnose. Das Barrett-Karzinom, welches am unteren Ende der Speiseröhre bzw. vor dem Mageneingang gelegen ist, gehört in der westlichen Welt zu den Tumorerkrankungen mit den höchsten Steigerungsraten (3,5 % bis 8,1 % pro Jahr), sodass auch dessen Diagnostik und Behandlung einen immer größeren Stellenwert im klinischen Alltag einnimmt. In den meisten Fällen stellt ein Barrett-Ösophagus (die Vorstufe eines invasiven Barrett-Karzinoms) einen Zufallsbefund dar, der im Rahmen einer Ösophago-Gastro-Duodenoskopie (Spiegelung der Speiseröhre, des Magens und des Zwölffingerdarms, kurz: ÖGD) erstmals diagnostiziert wird. In frühen, lokalisierten Tumorstadien verläuft die Erkrankung nicht selten symptomlos oder geht lediglich mit unspezifischen Beschwerden einher. Die typischen Symptome der Erkrankung, wie z.B. Schluckbeschwerden, das Erbrechen von Nahrungsbestandteilen in engem zeitlichen Zusammenhang mit dem Essen, ein daraus resultierender Gewichtsverlust oder ein Druck hinter dem Brustbein entstehen meist erst durch die lokale Ausbreitung des bösartigen Tumors. Zudem können wiederkehrendes Husten nach dem Essen (versursacht durch sogenannte „stumme Aspirationen“ charakteristisch sein. Allgemeine Tumorsymptome bestehen häufig in einer Müdigkeit (sogenannte „Fatigue“), einer verminderten Leistungsfähigkeit sowie Luftnot bei Belastung (Dyspnoe), die oftmals Ausdruck einer fortgeschrittenen Blutarmut sein können („Anämie“). Bei einer systematischen Ausbreitung des Tumors im Körper (Metastasierung) entsprechen die klinischen Beschwerden den Lokalisationen der Metastasen (z.B. rechtsseitige Oberbauchschmerzen bei Lebermetastasen, Rückenschmerzen bei Knochenmetastasen in der Wirbelsäule). Neben diesen körperlichen Beschwerden bringt die Diagnose „Barrett-Karzinom“ oftmals vielseitige weitere Veränderungen mit sich, die sich auf alle Lebensbereiche auswirken können. Zahlreiche Untersuchungen müssen durchgeführt werden, um das Krankheitsstadium bei Erstdiagnose erfassen zu können. Die unterschiedlichen Optionen der endoskopisch-lokalen, der chirurgischen oder der systemischen (z.B. medikamentösen) bzw. der Strahlen-Therapie werden nach Abschluss der Primär- und Ausbreitungsdiagnostik von Experten unterschiedlicher Fachrichtungen besprochen und gemäß aktuellstem medizinischen Wissen leitliniengerecht festgelegt. Das sogenannte Tumorboard setzt sich aus Chirurgen, Onkologen, Gastroenterologen, Radiologen, Strahlentherapeuten und Nuklearmedizinern zusammen. Im Anschluss wird mit den Patienten die bestmögliche Therapie besprochen und eingeleitet. In sehr frühen Stadien der Erkrankung (z.B. Barrett-Frühkarzinom) kann eine endoskopische Lokaltherapie (z.B. endoskopische Resektion des Tumors) kurativ und somit die einzige Behandlungsform darstellen. Bei den fortgeschrittenen Stadien kommen in aller Regel multimodale Konzepte zum Einsatz, wie z.B. medikamentöse („klassische“ Chemo-, zielgerichtete Antikörper- und / oder Immun-Therapien), strahlentherapeutische und chirurgische Optionen, die in abgestimmter Sequenz erfolgen.
Der Barrett-Ösophagus ist durch eine Veränderung der Schleimhaut der distalen Speiseröhre (Bereich am Übergang zwischen Speiseröhre (Ösophagus) und Magen, Ösophagus) gekennzeichnet (1). Das gesunde Oberflächengewebe (Plattenepithel) der Speiseröhre ist in diesem Bereich nicht auf den Kontakt mit der Säure des Magens spezialisiert. Normalerweise verhindert der Verschlussmechanismus des unteren Ösophagus, dass dieser schädigende Kontakt zwischen Mageninhalt und dem Gewebe der unteren Speiseröhre stattfindet. Kommt es z.B. im Rahmen der Gastroösophagealen Refluxerkrankung (GERD) zum wiederholten Rückfluss (Reflux) von Mageninhalt (und somit auch Magensäure), resultiert daraus eine Schädigung des gesunden, ortstypischen Plattenepithels. Durch verschiedene Mechanismen auf molekularer und zellulärer Ebene kommt es zur Umwandlung in ein Zylinderepithel vom intestinalen Typ mit Becherzellen (2). Die Veränderung kann über weitere Umwandlungsprozesse und einen langen Zeitraum potenziell zu einem Adenokarzinom der Speiseröhre führen (3) und stellt nach aktuellem Stand der Forschung die einzig anerkannte Vorstufe des Barrett-Krebses dar (4).
Laut aktueller Daten erhalten jährlich etwa 6.100 Männer und 1.800 Frauen in Deutschland die Diagnose „Speiseröhrenkrebs“ (5). Um diese Zahlen besser einordnen zu können, lohnt es sich, einen Blick auf die jährlichen Neuerkrankungsraten von zwei der häufigsten Tumorerkrankungen zu werfen. An Brustkrebs erkranken allein in Deutschland jährlich mehr als 70.800 Frauen, an Dickdarmkrebs jeweils rund 34.100 Männer, sodass die Tumorerkrankungen der Speiseröhre zu den vergleichsweise selteneren Tumorentitäten gezählt wird (6). Man geht aktuell davon aus, dass das Ösophaguskarzinom ca. 3% aller bösartigen Tumorerkrankungen bei Männern und etwa 1% Prozent bei Frauen ausmacht (7). Dennoch gehört das Barrett-Karzinom in der westlichen Welt zu den Tumorerkrankungen mit den höchsten Steigerungsraten (3,5 % bis 8,1 % pro Jahr) (8, 9). Die Ergebnisse wissenschaftlicher Studien haben gezeigt, dass das Karzinomrisiko eines Barrett-Ösophagus zwischen 0,10 % und 0,15 % pro Jahr liegt (10). Während das Plattenepithelkarzinom weltweit die häufigste Form ist, ist das Adenokarzinom in vielen westlichen Ländern die am weitesten verbreitete Form des Speiseröhrenkrebses (11).
Die Gastroösophageale Refluxerkrankung (GERD) gilt als der wichtigste Risikofaktor für Entstehung eines Barrett-Ösophagus, wobei das Risiko mit dem Schweregrad und der Dauer der Refluxsymptomatik zu korrelieren scheint (12). Mehre epidemiologische Studien haben gezeigt, dass Fettleibigkeit (Adipositas, Body-Mass-Index >30kg/m²) aufgrund der mechanischen Begünstigung des Refluxes infolge der Druckerhöhung im Bauchraum ein wichtiger Risikofaktor für die Entwicklung der GERD ist (13, 14) und somit auch einen relevanter Risikofaktor für die Entwicklung eines Barrett-Ösophagus/-karzinom darstellt. Auch hinsichtlich des Geschlechts und Erkrankungsalters konnten bereits wichtige Erkenntnisse gewonnen werden: Männer sind von der Barrett-Erkrankung viermal häufiger betroffen als Frauen, wobei weibliche Patientinnen etwa 20 Jahre später an einem Barrett-Ösophagus erkranken als Männer (15). Weitere Risikofaktoren sind das Rauchen, was das Risiko ungefähr verdoppelt, und eine obst- und gemüselose Ernährung (16). Des Weiteren weist der Barrett auch eine familiäre Häufung auf, sodass man aktuell davon ausgeht, dass genetische Faktoren bei ca. 5-10% der Patienten für die Entstehung dieser Erkrankung verantwortlich sind (17, 18). Der Barrett-Ösophagus erhöht das Risiko für das Auftreten eines Adenokarzinoms der Speiseröhre (Barrett-Karzinom) um das 30-fache im Vergleich zur Allgemeinbevölkerung (19).
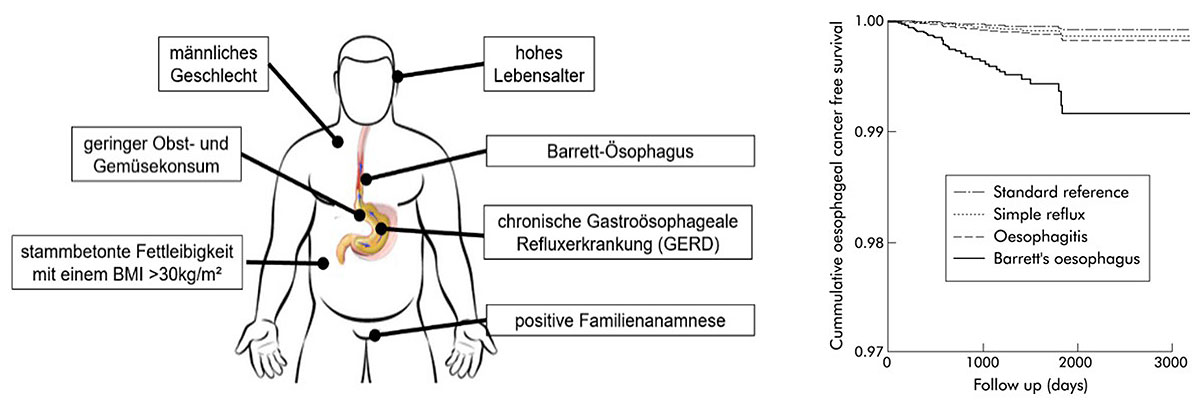
Abb. 1: links: Übersicht über die Risikofaktoren eines Barrett-Karzinoms. rechts: Darstellung des krebsfreien Überlebens, das bei einem bestehenden Barrett-Ösophagus deutlich geringer ist als bei der Allgemeinbevölkerung.
Diagramm-Quelle: Solaymani-Dodaran M, Logan RF, West J, Card T, Coupland C. Risk of oesophageal cancer in Barrett's oesophagus and gastro-oesophageal reflux. Gut. 2004 Aug;53(8):1070-4. doi: 10.1136/gut.2003.028076. PMID: 15247170; PMCID: PMC1774141.
Die Refluxkrankheit (GERD) ist ein wesentlicher Risikofaktor für die Entstehung des Barrett-Ösophagus und dem damit assoziierten Barrett-Karzinom (20). Bei 60% der Patienten mit Adenokarzinomen der Speiseröhre ist eine GERD Ursache für das Tumorleiden, während bei den restlichen 40% keine klinischen Hinweise auf eine gastroösophageale Refluxkrankheit vorliegt (21). Der Barrett-Ösophagus ist durch die metaplastische Umwandlung (Umwandlung einer differenzierten Gewebe- oder Zellart in eine andere) des normalen Plattenepithels des distalen Ösophagus in ein sogenanntes „intestinalisiertes“, einschichtiges Zylinderepithel (charakteristischerweise mit Becherzellen) gekennzeichnet (22). Aktuell geht man davon aus, dass sich der Barrett-Ösophagus schrittweise von einer intestinalen Metaplasie über Sequenzen von niedriggradiger („Low grade“) intraepithelialer Neoplasie (LG-IEN) (Gewebe mit pathologischer Gewebearchitektur und geringen zellulären Atypien) und hochgradiger („High grade“) intraepithelialer Neoplasie (HG-IEN) (Gewebe mit pathologischer Gewebearchitektur und hochgradigen zellulären Atypien) hin zum Adenokarzinom (der Tumorerkrankung) entwickelt, wobei der zeitliche Verlauf solch einer Progression (Voranschreitens) hoch variabel ist (23, 24). Zellbiologisch zeichnet sich der Metaplasie-Dysplasie-Karzinom-Prozess durch eine zunehmende Proliferationsrate (Zellteilungsrate), Differenzierungsverlust (fehlende Ausreifung des Gewebes), die Expression von Wachstumsfaktoren und Adhäsionsmolekülen (Moleküle für den Zusammenhalt der Zellen) sowie durch abnormales Apoptoseverhalten (Verhinderung des Zelltods) aus (25). Auch wenn die Wissenschaft seit der Entdeckung der Erkrankung in der Mitte des 20. Jahrhunderts ein immer größeres Interesse an der Erforschung der einzelnen Mechanismen von der gesunden Schleimhaut bis hin zur Tumorerkrankung hat, konnte die Pathogenese (die exakte Entstehung der Erkrankung) noch immer nicht abschließend und allumfassend geklärt werden (26).
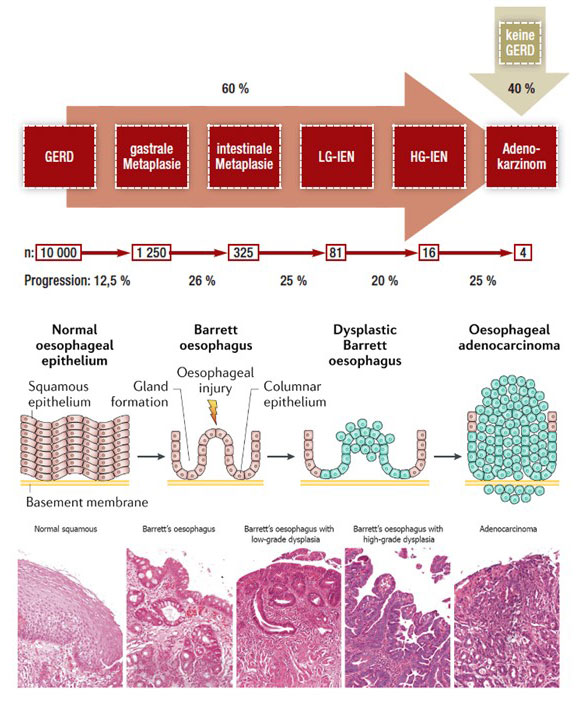
Abb. 2: Schritte von der Gastroösophagealen Refluxerkrankung (GERD) zum Barrett-Karzinom unter Angabe des jeweiligen Risikos zum Fortschreiten zur nächsten Zwischenstufe.
Bildquelle: https://www.aerzteblatt.de/callback/image.asp?id=67239
Abb. 3: Schematische Darstellung der zellulären Veränderungen von der normalen Ösophagusschleimhaut zum Barrett-Karzinom (oben) und den dazugehörigen mikroskopischen Gewebeveränderungen (unten).
Quelle oberes Bild: https://f6publishing.blob.core.windows.net/95e35c83-90b4-4b76-9752-5ab5ff5eeda9/WJG-16-5669-g001.jpg
Quelle unteres Bild: https://media.springernature.com/full/springer-static/image/art%3A10.1038%2Fs41572-019-0086-z/MediaObjects/41572_2019_86_Fig1_HTML.png
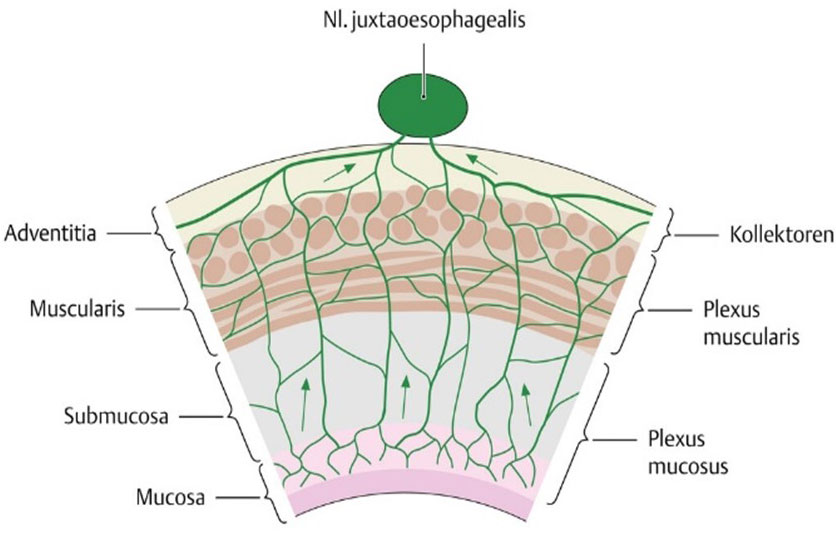
Abb. 4: Darstellung des Lymphgefäßsystems der Speiseröhre, das bereits in der Schleimhautschicht (Mukosa) beginnt und dann, verlaufende durch alle Wandschichten, in den verschiedenen regionalen Lymphknoten zusammenläuft.
Bildquelle: https://eref.thieme.de/cockpits/clAna0001/0/coAna00072/4-9339
Die typischen Symptome der Erkrankung, wie z.B. Schluckbeschwerden, das Erbrechen von Nahrungsbestandteilen in engem zeitlichem Zusammenhang mit dem Essen, ein daraus resultierender Gewichtsverlust oder ein Druck hinter dem Brustbein entstehen meist erst durch die lokale Ausbreitung des bösartigen Tumors. Zudem können wiederkehrendes Husten nach dem Essen (versursacht durch sogenannte „stumme Aspirationen“) charakteristisch sein. Allgemeine Tumorsymptome bestehen häufig in einer Müdigkeit (sogenannte „Fatigue“), einer verminderten Leistungsfähigkeit sowie in einer Luftnot bei Belastung (Dyspnoe), die oftmals Ausdruck einer fortgeschrittenen Blutarmut (Anämie) sein können. Bei einer systematischen Ausbreitung des Tumors im Körper (Metastasierung) entsprechen die klinischen Beschwerden den Lokalisationen der Metastasen (z.B. rechtsseitige Oberbauchschmerzen bei Lebermetastasen, Rückenschmerzen bei Knochenmetastasen in der Wirbelsäule).
Bei vielen Präventionsansätzen der letzten Jahre besteht noch immer eine kontroverse Studienlage. Obwohl es mehrere potenzielle Präventionsmaßnahmen gibt, konnte in prospektiven, gut konzipierten Studien keine Verringerung des Ösophaguskarzinomrisikos nachgewiesen werden (33). Es konnte jedoch gezeigt werden, dass sich eine Reduktion der Risikofaktoren wie z.B. die Therapie der chronisch bestehenden Refluxerkrankung, eine Reduktion des Körpergewichts oder eine ausgewogene Ernährung mit Obst und Gemüse risikoreduzierend auf die Entstehung eines Barrett-Karzinoms auswirken können (34). Bei Patienten mit einem Barrett-Ösophagus werden regelmäßige Kontrolluntersuchungen mittels Endoskopie und einer 4-Quadratentenbiopsie alle 2 cm empfohlen (35). Ziel der Überwachung ist die frühzeitige Erkennung von Dysplasien (s.o.) (36). Bei der endoskopischen Überwachung sollte eine hochauflösende Weißlicht-Endoskopie (High definition white light endoscopy, HDWLE) in Kombination mit modernen endoskopischen Bildgebungsverfahren zur Visualisierung der Schleimhaut eingesetzt werden (37). Die Überwachungsintervalle richten sich nach dem Grad der Dysplasie (38):
Der erste wichtige Schritt für die Diagnosestellung eines Barrett-Karzinoms besteht in der Durchführung der Ösophago-Gastro-Duodenoskopie, also der Spiegelung der Speiseröhre inklusive des Übergangsbereichs in den Magen (gastroösophagealer Übergang), des Magens selbst und des Zwölffingerdarms. Sofern bereits Veränderungen der Ösophagusschleimhaut mit bloßem Auge sichtbar sind, werden aus diesen Proben zur weiteren Untersuchung unter dem Mikroskop in die Pathologie geschickt. Unterstützend oder falls diese makroskopischen Veränderungen fehlen, können verschiedene chemische (z.B. Essigsäure) oder technische (z.B. Chromoendoskopie) Methoden angewandt werden, um frühe Neoplasien besser detektieren und vom nicht-dysplastischen Barrett-Epithel abgrenzen zu können. Sind im Rahmen dessen auffällige Bereich detektiert worden, erfolgt auch an dieser Stelle wieder eine Probengewinnung (Biopsie) und die Untersuchung in der Pathologie.
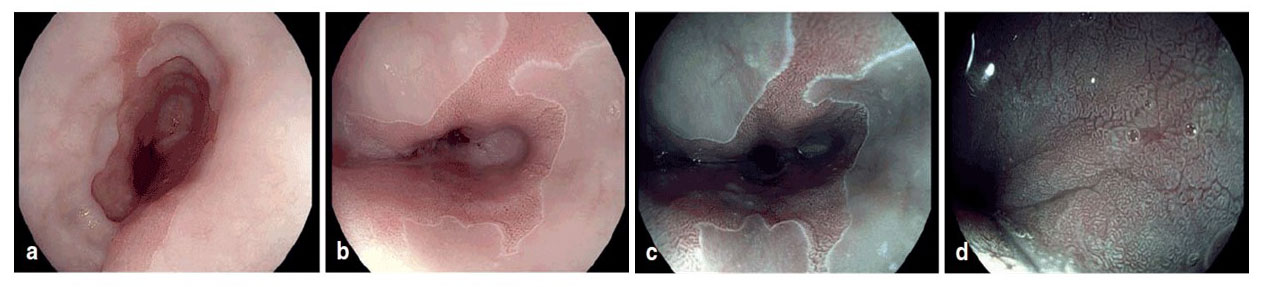
Abb. 5: Endoskopische Bilder eines Barrett-Ösophagus mit HD-Endoskopie und Essigsäure (a+b) zur Kontrastverstärkung sowie elektronischer Bildbearbeitung (c+d).
Bildquelle: https://www.aerzteblatt.de/callback/image.asp?id=67233
Mit Hilfe verschiedener Färbemethoden und unter Zuhilfenahme des Mikroskops können spezifische Veränderungen sichtbar gemacht werden, die charakteristisch für eine bösartige Tumorerkrankung sind. Man spricht vom Nachweis zellulärer Atypien:
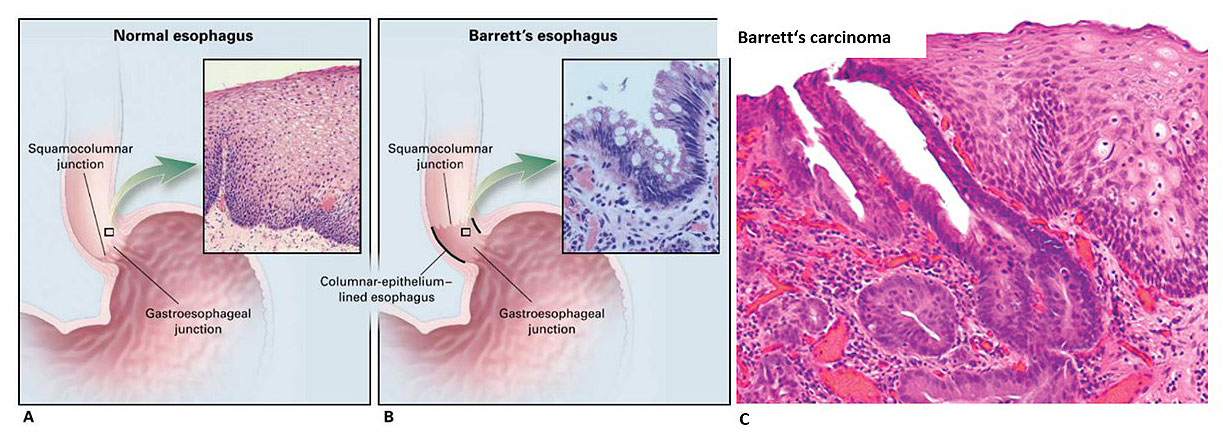
Abb. 6: Mikroskopische Veränderungen und Unterschiede zwischen einer normalen Speiseröhrenschleimhaut (A), dem Barrett-Ösophagus (B) und einem Barrett-Karzinom (C).
Quelle (Bild A,B): https://mediatum.ub.tum.de/doc/1506540/1506540.pdf
Quelle (Bild C): https://www.medical-tribune.de/fileadmin/Medizin_und_Forschung/Artikelbilder/20180403_speiseroehrenkrebs_wikimedia_823.png
Die Tumorerkrankungen der Speiseöhre werden nach der TNM-Klassifikation (englisch: tumor, node, metastasis) eingeteilt, wobei hauptsächlich 3 Punkte maßgeblich für die weitere Therapiestrategie sind (39):
Die Bestimmung der T- sowie der N-Kategorie kann sowohl klinisch (dann mit einem „c“ davor, z.B. cT1) als auch pathologisch nach Resektion (dann mit einem „p“ davor, z.B. pT1) erfolgen.
Am endoskopischen oder chirurgischen Resektat können zusätzlich noch folgende prognose- und therapierelevante Faktoren erhoben werden (40):
Um die Einteilung der T-Kategorie nachvollziehen zu können, lohnt es sich, einen Blick auf den Wandbau der Speiseröhre zu werfen. Dieser besteht aus verschiedenen Schichten, die von innen (dem Lumen) nach außen (Körperhöhlen) verschiedene Namen tragen (41):
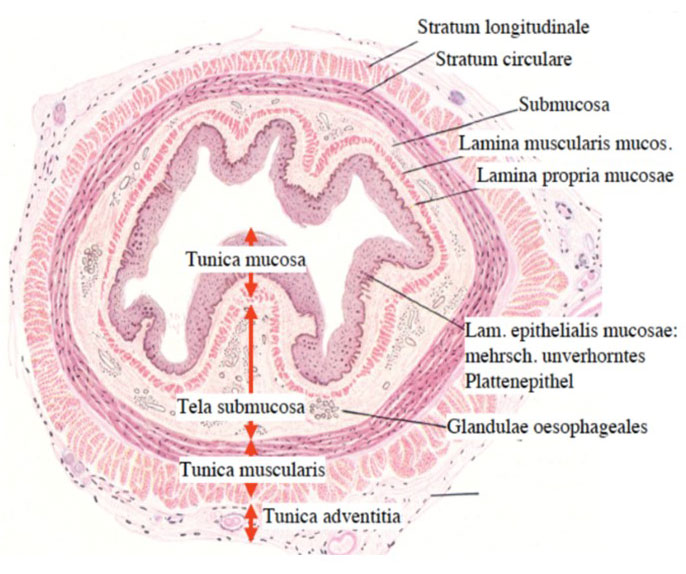
Abb. 7: Schematische Darstellung der Wandschichten der Speiseröhre mit deren Fachbezeichnungen.
Bildquelle: https://histohelp.files.wordpress.com/2011/09/screen-capture7.png
Während bei den oberflächlichen Karzinomen die aktuell gültige TNM-Klassifikation lediglich zwischen einem Vordringen der Tumorzellen in die Mukosa (pT1a) bzw. bis in die Submukosa (pT1b) unterscheidet, existieren hier noch differenziertere Unterteilungen der T1-Tumoren (42). Im Rahmen der japanischen Klassifikation der Frühkarzinome wird die Mukosa wiederum in 3 Schichten (m1-3) eingeteilt (von innen nach außen):
Zudem wird nach dieser Klassifikation die Submukosa ebenfalls in drei Drittel (sm1-3) eingeteilt.
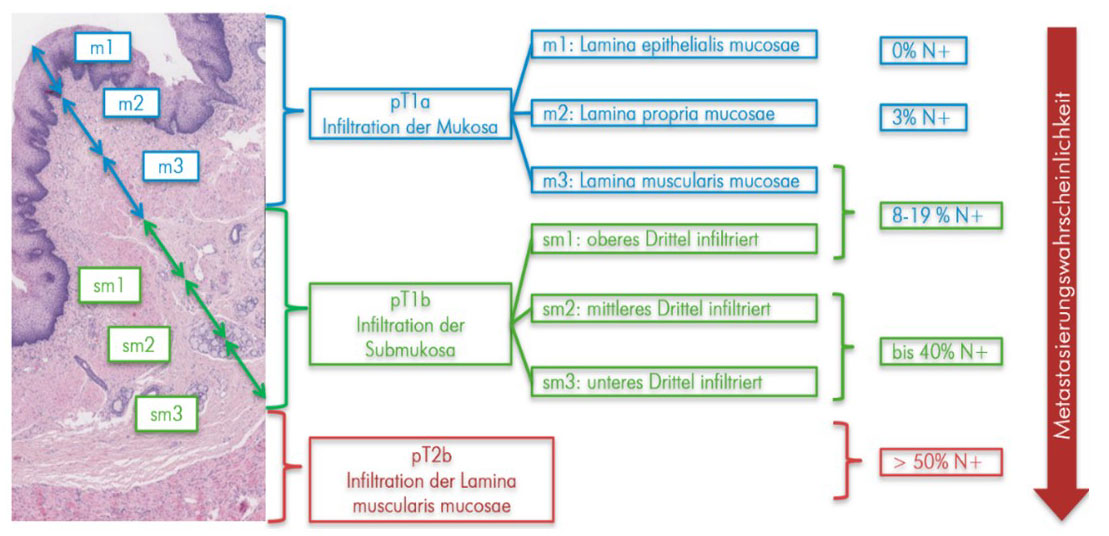
Abb. 8: Aufbau und Einteilung der ersten beiden Wandschichten (Mukosa und Submukosa) der Speiseröhre. Die innerste Schicht (Mukosa) wird wiederum in 3 Schichten eingeteilt (m1 bis m3). Auch die darauffolgende Submukosa wird in Drittel eingeteilt (sm1 bis sm3). Auf der rechten Seite ist das Risiko aufgeführt,wie wahrscheinlich das Auftreten von Metastasen ist, sollte diese Schicht vom Tumor befallen sein.
Bildquelle histologischer Schnitt: modifiziert nach https://next.amboss.com/de/article/6K0jhS
Wie auf der Abbildung zu erkennen ist, spielt diese Sub-Klassifikation der oberflächlichen Schichten für die Wahl der Therapie und die Wahrscheinlichkeit des Auftretens von Metastasen eine wichtige Rolle.
Für die Feststellung der T-Kategorie wird die Infiltrationstiefe der Tumorzellen bestimmt, d.h. bis in welche Wandschicht können Tumorzellen mit den o.g. Auffälligkeiten unter dem Mikroskop gefunden werden:
Vordringen der Tumorzellen:
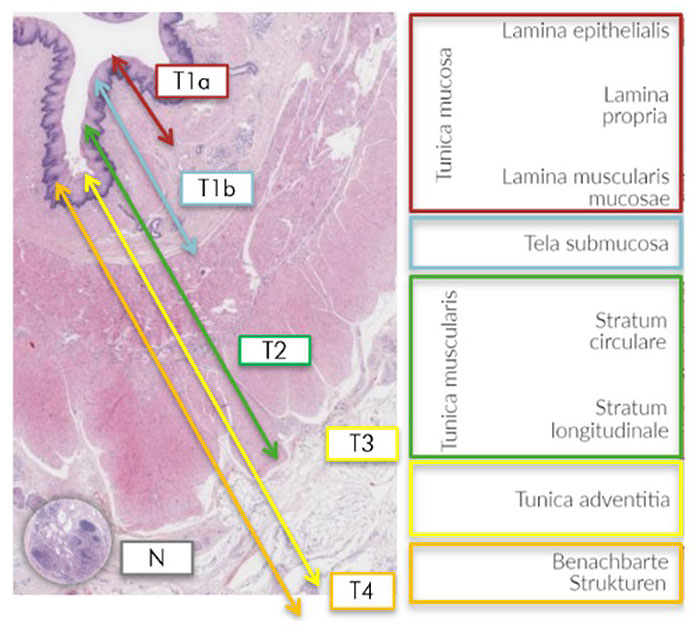
Abb. 9: Übersicht über die Zuordnung der T-Klassifikation zur jeweiligen Eindringtiefe der Tumorzellen.
Bildquelle: modifiziert nach https://next.amboss.com/de/article/6K0jhS
Zur Feststellung der N-Kategorie werden die regionären (benachbarten) Lymphknoten beurteilt, d.h. es können in diesen Tumorzellen nachgewiesen werden:
Unter Zuhilfenahme verschiedener Untersuchungsmethoden (z.B. die Computertomographie (CT) oder der Positronen-Emissions-Tomographie (PET-CT)) können Fernmetastasen, also Tumorabsiedlungen in anderen Organen, ausgeschlossen oder detektiert werden:
Wenn alle o.g. Aspekte untersucht sind, kann aus der Kombination der Angaben zur T-, N- und M-Kategorie ein Tumor-Stadium ermittelt werden. Die gebräuchlichste Einteilung erfolgt in die UICC-Stadien („Union internationale contre le cancer“, UICC) von I bis IV (43):
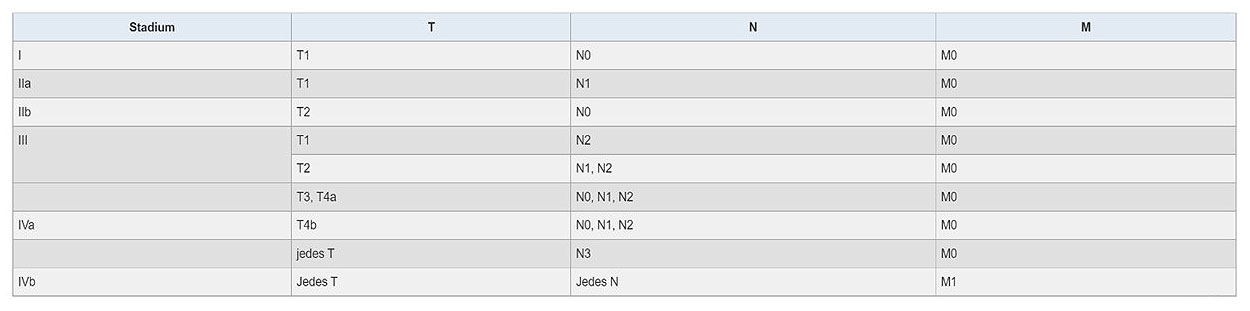 Abb. 10: Stadieneinteilung des Barrett-Karzinoms nach UICC (Union for International Cancer Control ).
Abb. 10: Stadieneinteilung des Barrett-Karzinoms nach UICC (Union for International Cancer Control ).
Quelle der Tabelle: https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
Basierend auf dieser Stadieneinteilung erfolgt die Auswahl der jeweiligen, sogenannten „stadiengerechten“ Therapiestrategie, deren Einsatz in zahlreichen klinischen Studien überprüft und durch eine Expertenkommission für das jeweilige Tumorstadium festgelegt wurde:
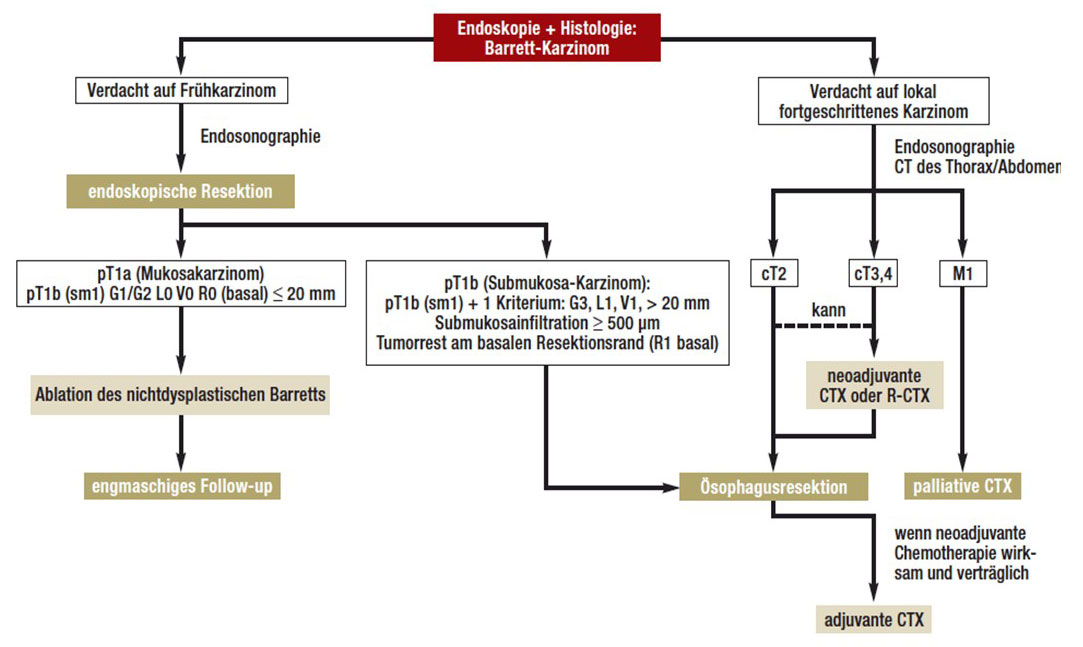
Abb. 11: Übersicht über die Therapiemöglichkeiten des Barrett-Karzinoms (BK). Oberflächliche Karzinome werden in der Regel mit endoskopischen Verfahren therapiert. Die Methode der Wahl für das lokal begrenzte BK (cT2) ist die chirurgische Therapie, während beim lokal fortgeschrittenen Tumor (cT3,4, N+) eine (Radio-) Chemotherapie vor und ggf. auch nach der Operation durchgeführt wird. Beim metastasierten BK (M1) erfolgt eine palliative Therapie mit dem Ziel der Symptomkontrolle.
Bildquelle: https://www.aerzteblatt.de/callback/image.asp?id=67241
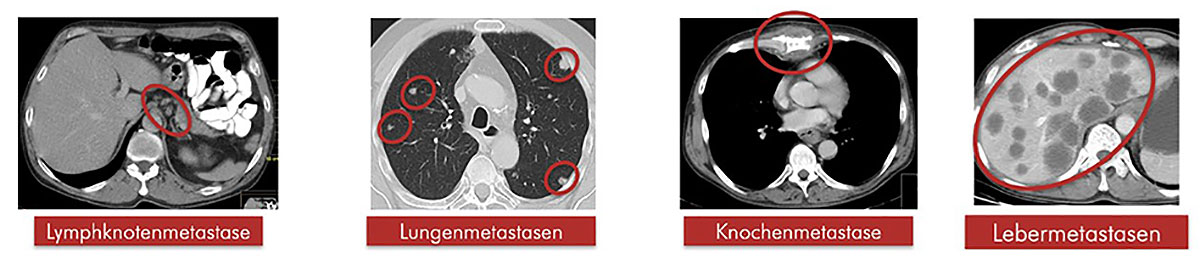
Unter einer Metastasierung versteht man eine Absiedelung von Tumorzellen in Gewebe / Strukturen oder Organe, welche außerhalb bzw. fernab des Primärtumors lokalisiert sind. Prinzipiell unterscheidet man zwischen folgenden Metastasierungsformen:
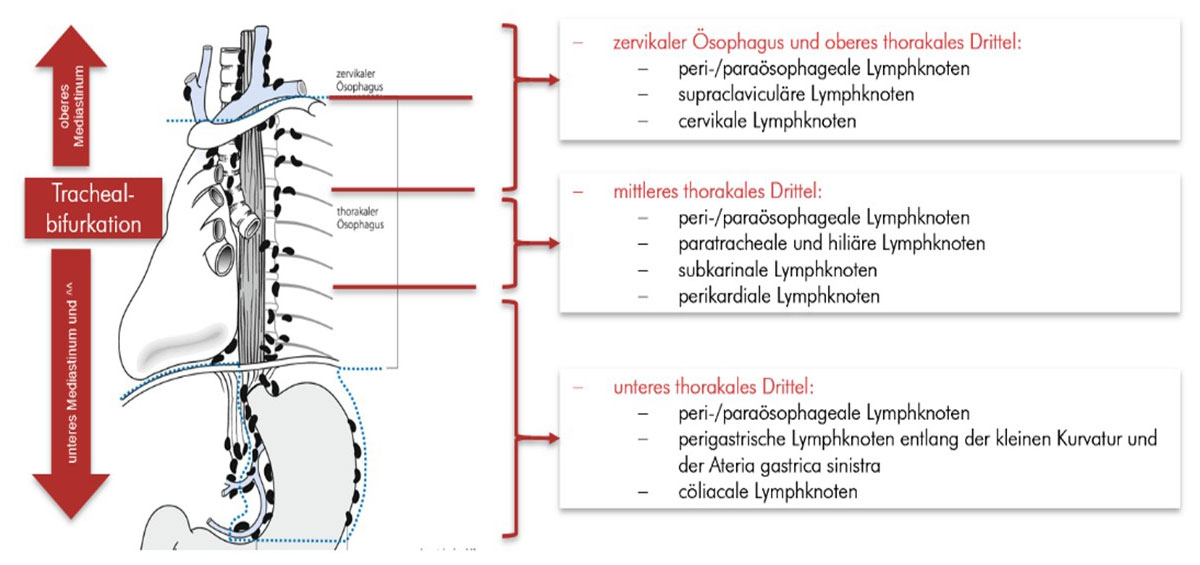
Abb. 12:Darstellung der verschiedenen Lymphknotenstationen der Speiseröhre. Je nach Höhe des Tumors erfolgt die Metastasierung entlang des Lymphabflussgebiets der jeweiligen Region. Tumore oberhalb der Aufteilung der Luftröhre bilden eher Metastasen in den Lymphknoten des Kopf-Hals-Bereiches, unterhalb der Aufzweigung eher im Bereich des Brustkorbs und unterhalb des Zwerchfells.
Bildquelle: modifiziert nach https://media.springernature.com/original/springer-static/image/chp%3A10.1007%2F978-3-662-56577-3_12/MediaObjects/191480_2_De_12_Fig2_HTML.gif
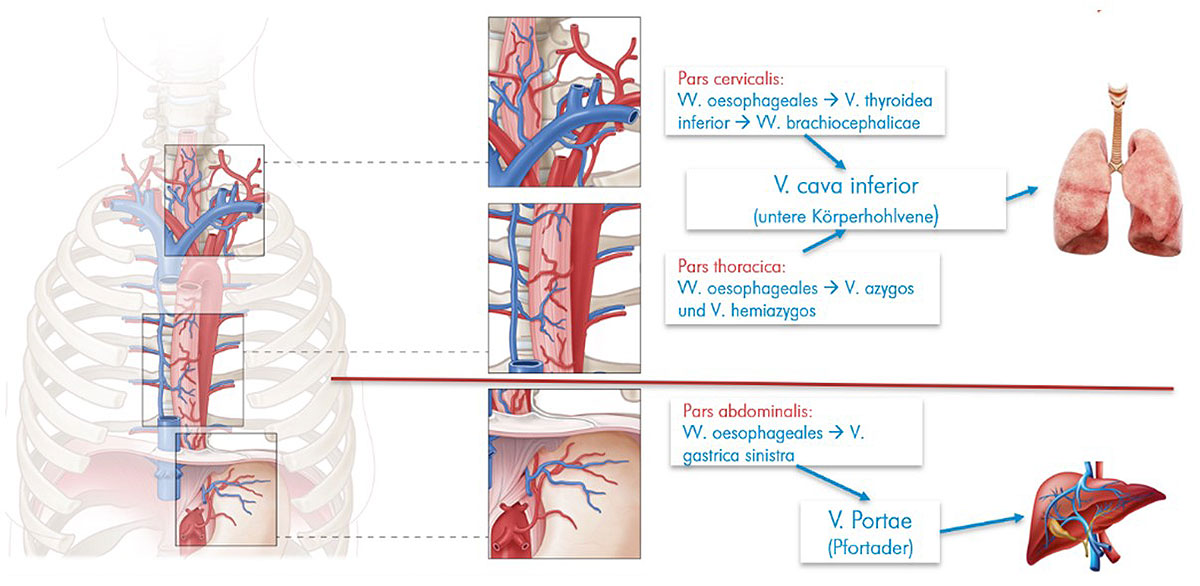 Abb. 13: Übersicht über die Ausbreitung der Tumorzellen über das Venensystem (hämatogene Metastasierung). Der Abfluss des sauerstoffarmen Blutes der Speiseröhre im oberen und mittleren Drittel erfolgt über verschiedene Zwischenstationen in die Lunge, während der venöse Abfluss der im Bauch gelegenen Speiseröhre nach mehreren Zwischenschritten in die Leber erfolgt.
Abb. 13: Übersicht über die Ausbreitung der Tumorzellen über das Venensystem (hämatogene Metastasierung). Der Abfluss des sauerstoffarmen Blutes der Speiseröhre im oberen und mittleren Drittel erfolgt über verschiedene Zwischenstationen in die Lunge, während der venöse Abfluss der im Bauch gelegenen Speiseröhre nach mehreren Zwischenschritten in die Leber erfolgt.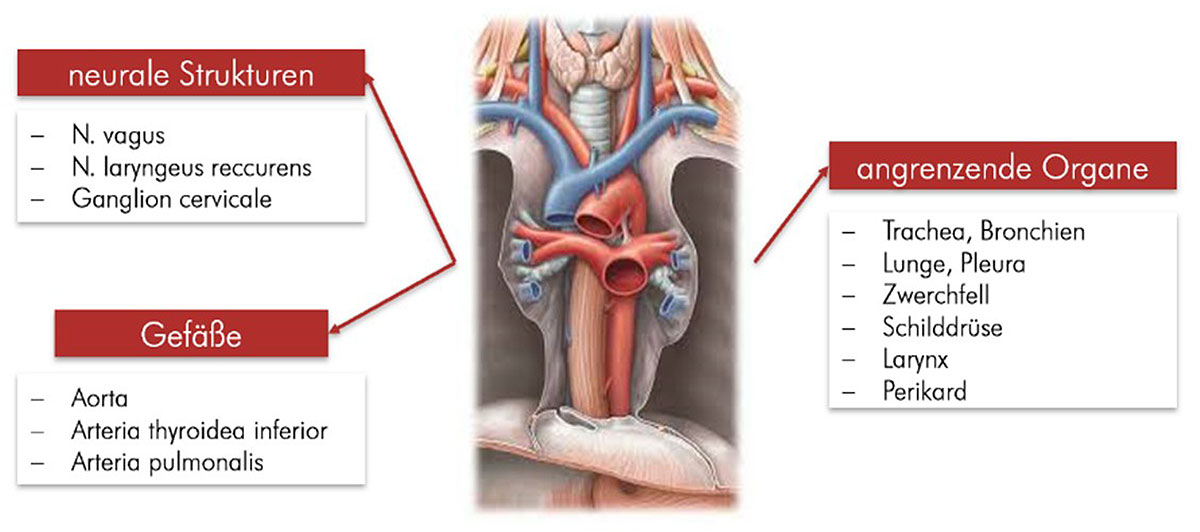 Abb. 14: Darstellung der Lagebeziehung der Speiseröhre im Brustkorb. Der Ösophagus liegt in enger räumlicher Beziehung zu verschiedenen Gefäß- und Nervenstrukturen sowie anderen Organen, die im Rahmen einer Tumorausbreitung in Mitleidenschaft gezogen werden können.
Abb. 14: Darstellung der Lagebeziehung der Speiseröhre im Brustkorb. Der Ösophagus liegt in enger räumlicher Beziehung zu verschiedenen Gefäß- und Nervenstrukturen sowie anderen Organen, die im Rahmen einer Tumorausbreitung in Mitleidenschaft gezogen werden können.Das „Staging“ (= Stadienbestimmung) bezeichnet in der Onkologie den Teil der Diagnostik, der der Feststellung des Ausbreitungsgrades einer bösartigen Tumorerkrankung dient (44). Letztendlich wird anhand dieses Stagings festgelegt, ob der Tumor kurativ resektabel ist.
Zu den obligaten Untersuchungen gehören:
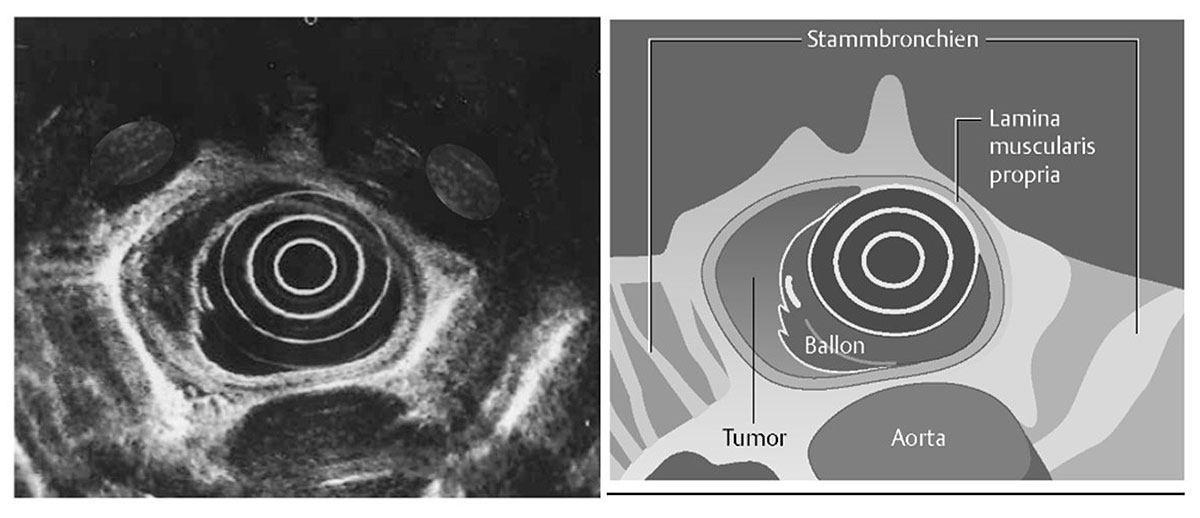
Ergänzend dazu können unter bestimmten Indikationen weitere Untersuchungen (z.B. Bronchoskopie (Spiegelung der Atemwege) oder eine PET-CT durchgeführt werden. Neben dieser Abklärung der „technischen“ Resektabilität, die immer vor jeder Therapie steht, empfehlen wir auch eine Evaluation der „funktionellen“ Operabilität, d.h. einer gründlichen Untersuchung der Herz-, Kreislauf- und Lungenfunktion. Häufig angewandte Untersuchungsmethoden hierbei sind, insbesondere bei entsprechender Risikokonstellation (z.B. bei langjährigem Nikotinkonsum), Herzultraschall, Gefäßdoppler und Lungenfunktionstest. Leber- und Nierenfunktion können sehr gut mit den Routine-Laborwerten bzw. im Standard-Ultraschall des Bauchraums erfasst werden. Mit Hilfe der Ergebnisse aller o.g. Funktionellen Tests sowie dem klinischen Gesamtzustand des Patienten inklusive der vorliegenden Begleiterkrankungen führen wir bereits zu diesem Zeitpunkt eine sogenannte Risiko-Abschätzung für die weitere chirurgische Therapie durch („Risiko-Scores“), um jeden Patienten möglichst optimal und individuell für die spätere OP vorzubereiten.
Das multidisziplinäre Tumorboard, bestehend aus Experten der Radiologie, Nuklearmedizin, Pathologie, Onkologie, Gastroenterologie, Strahlentherapie und Chirurgie kommt in aller Regel einmal wöchentlich zusammen und gibt Empfehlungen gemäß aktuellen Leitlinien und Studien (45). Die Therapiekonzepte werden auf die jeweilige Situation des Patienten individuell angepasst. In Rahmen der interdisziplinären Tumorkonferenzen sind den verschiedenen Fachdisziplinen unterschiedliche Aufgabenbereiche zugeordnet (46):
Der Beschluss der Tumorkonferenz wird anschließend elektronisch im Krankenhausinformationssystem dokumentiert und ist allen Ärzten zugänglich, die an der Behandlung des Patienten beteiligt sind (47). Auch im Verlauf von Therapien (z.B. Chemo- oder Strahlentherapie, Operation), werden die Befunde wiederholt vorgestellt, um die Behandlungserfolge und entsprechende Therapiemaßnahmen immer wieder zu adjustieren.
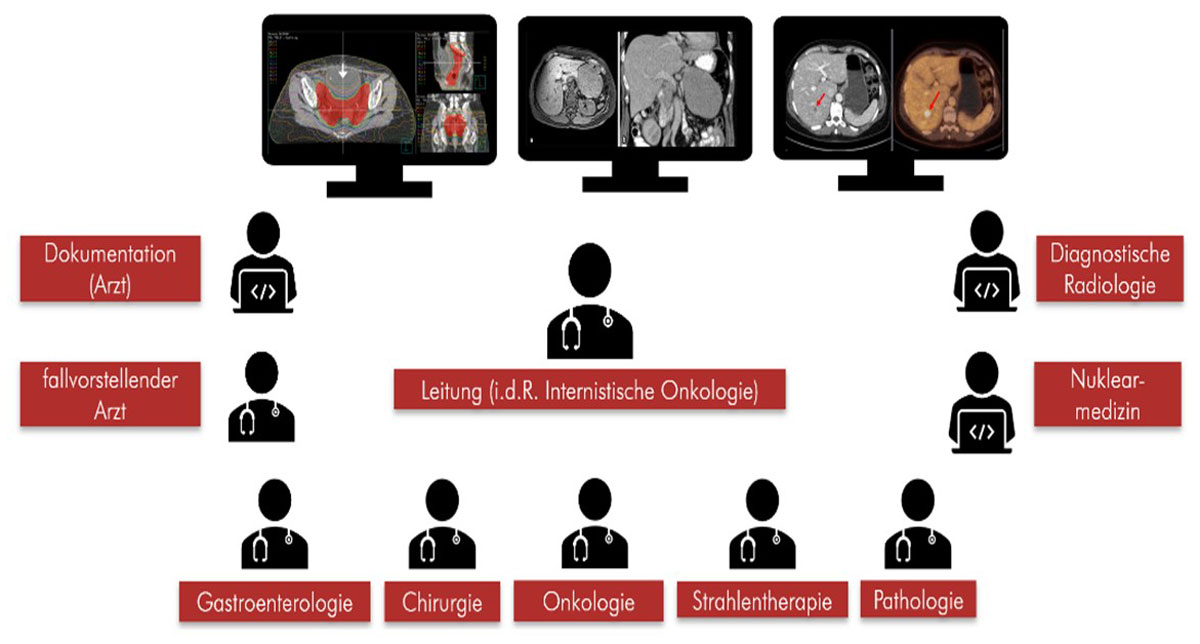
Abb. 17: Übersicht über die beteiligten Personen und Fachdisziplinen im Interdisziplinären Tumorboard, welches gemeinsam die jeweilige Therapiestrategie für den Patienten festlegt.
Bildquelle Monitor links: https://www.journalonko.de/app/webroot/js/kcfinder/upload/images/_Zeitschrift_JOURNALONKO/2015_09/S_609/Abb_8_Bestrahlungsplan_VMAT_Rotationstechnik.png
Bildquelle Monitor Mitte: https://media.springernature.com/lw685/springer-static/image/art%3A10.1007%2Fs00104-015-3007-z/MediaObjects/104_2015_3007_Fig1_HTML.jpg
Bildquelle Monitor rechts: https://www.hancken.de/wp-content/uploads/2019/02/lebermetastot.jpg
Sowohl im Falle einer Infiltration der Mukosa (T1a) als auch einer Infiltration der Submukosa (T1b) handelt es sich um einen prognostisch sehr günstigen, oberflächlichen Tumor. Basierend auf klinischen Studien wurden Grenzen für das Einwachsen von Tumorzellen festgelegt, die spezielle Therapieformen definieren.
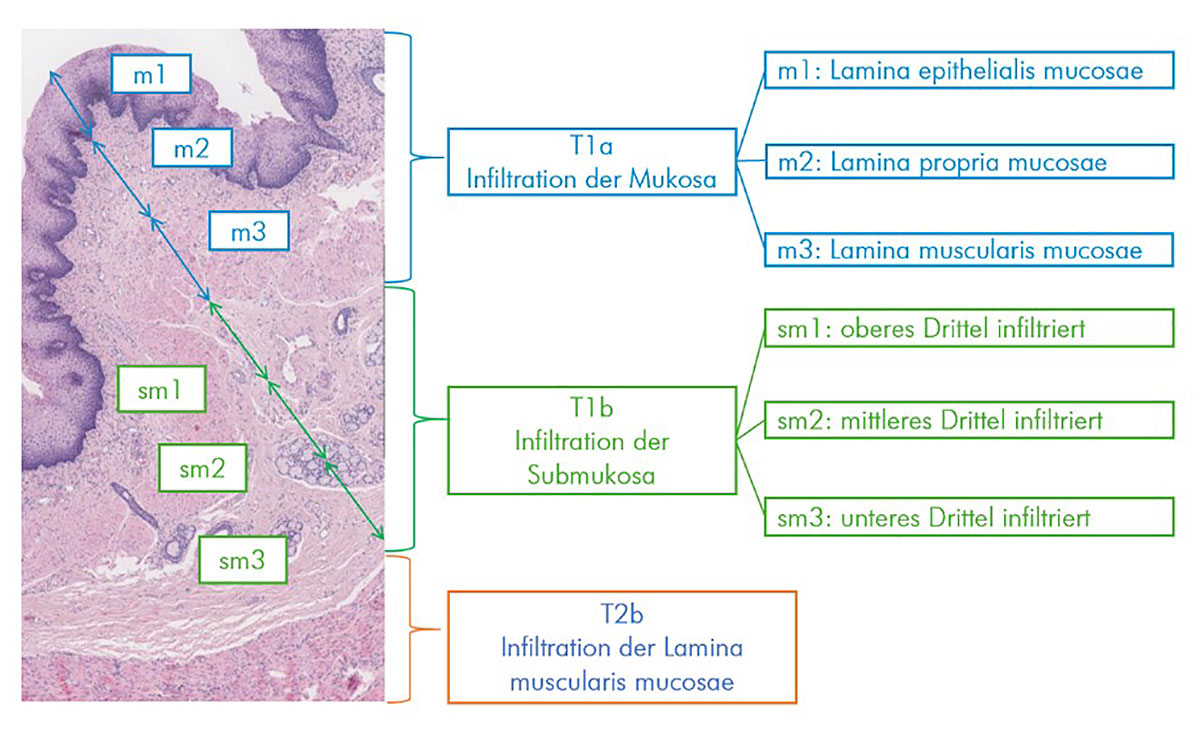
Abb. 18: Aufbau und Einteilung der ersten beiden Wandschichten (Mukosa und Submukosa) der Speiseröhre. Die innerste Schicht (Mukosa) wird wiederum in 3 Schichten eingeteilt (m1 bis m3). Auch die darauffolgende Submukosa wird in Drittel eingeteilt (sm1 bis sm3). Auf der rechten Seite ist das Risiko aufgeführt,wie wahrscheinlich das Auftreten von Metastasen ist, sollte diese Schicht vom Tumor befallen sein.
Bildquelle: modifiziert nach https://next.amboss.com/de/article/6K0jhS
Das Mittel der Wahl bei den Karzinomen der Mukosa-Schicht (T1a) stellt die endoskopische Resektion dar. Die Rationale beruht auf dem sehr geringen Metastasierungsrisiko (48). Patienten mit oberflächlicher Submukosainfiltration (T1 sm1) eines Adenokarzinoms und fehlenden Risikokriterien (z.B. <500 µm Tiefeninvasion, Tumordurchmesser unter 2cm, kein Einbruch in Lymph- (L0) oder Blutgefäße (V0), keine Ulzeration) kann nach interdisziplinärer Diskussion die endoskopische Resektion angeboten werden (49). Karzinome, die in die oberflächliche Submukosa eindringen (T1 sm1) und zusätzlich eines oder mehrere der o.g. Risikofaktoren aufweisen sowie Tumoren, die in tiefere Schichten der Submukosa infiltrieren (T1 sm2–3), führen ein Metastasierungsrisko in die Lymphknoten von 30–50% mit sich, sodass hier die Indikation zu einer chirurgischen Therapie gegeben ist (50).
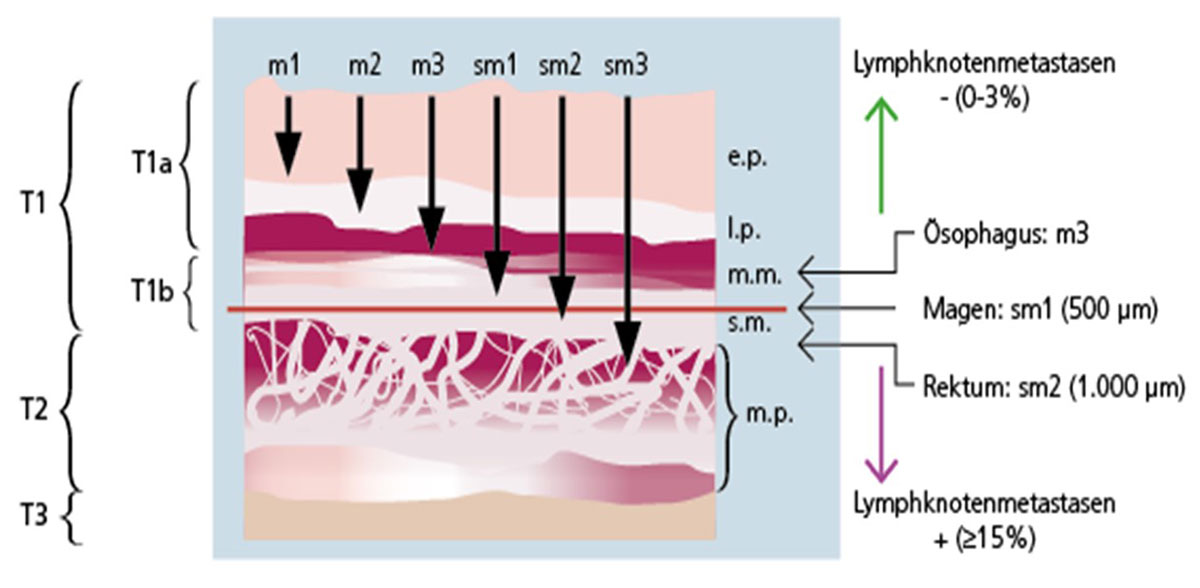
Abb. 19: Schematische Darstellung des Metastasierungsrisikos bei verschiedenen Tumoren des Verdauungstraktes.Reicht das Barrett-Karzinom tiefer als in das erste Drittel der Submukosa (≥sm1), steigt das Metastasierungsrisiko in Lymphgefäße um ein vielfaches an.
Bildquelle: https://www.journalonko.de/files/article/image/3203/Abb_1.png
Die endoskopische Resektion (ER) oberflächlicher Adenokarzinome des Ösophagus (pT1) stellt primär auch ein diagnostisches Verfahren dar. Nach Abschluss der histopathologischen Beurteilung wird das weitere therapeutische Procedere festgelegt (51). Komplikationen der ER sind in erfahrenen Zentren sehr selten (z.B. Perforation oder Blutung) und bedürfen eines sofortigen interdisziplinären Managements.
Prinzipiell kommen 2 endoskopische Verfahren zur Anwendung:
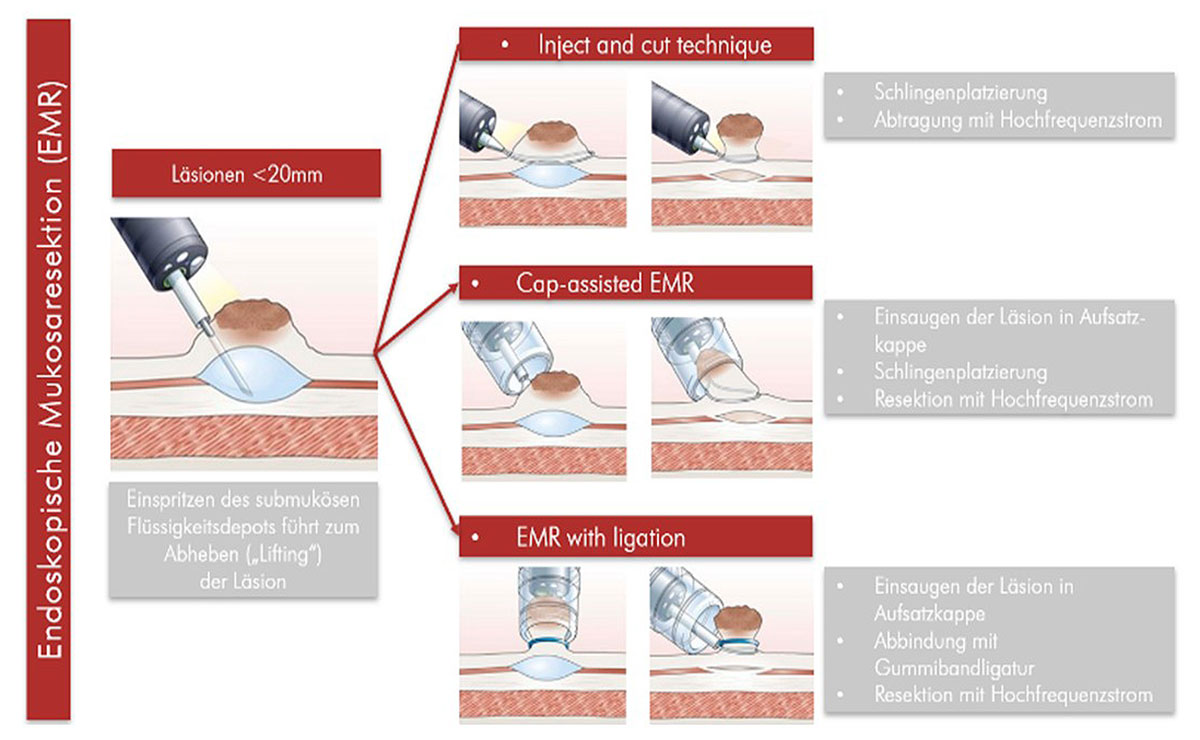
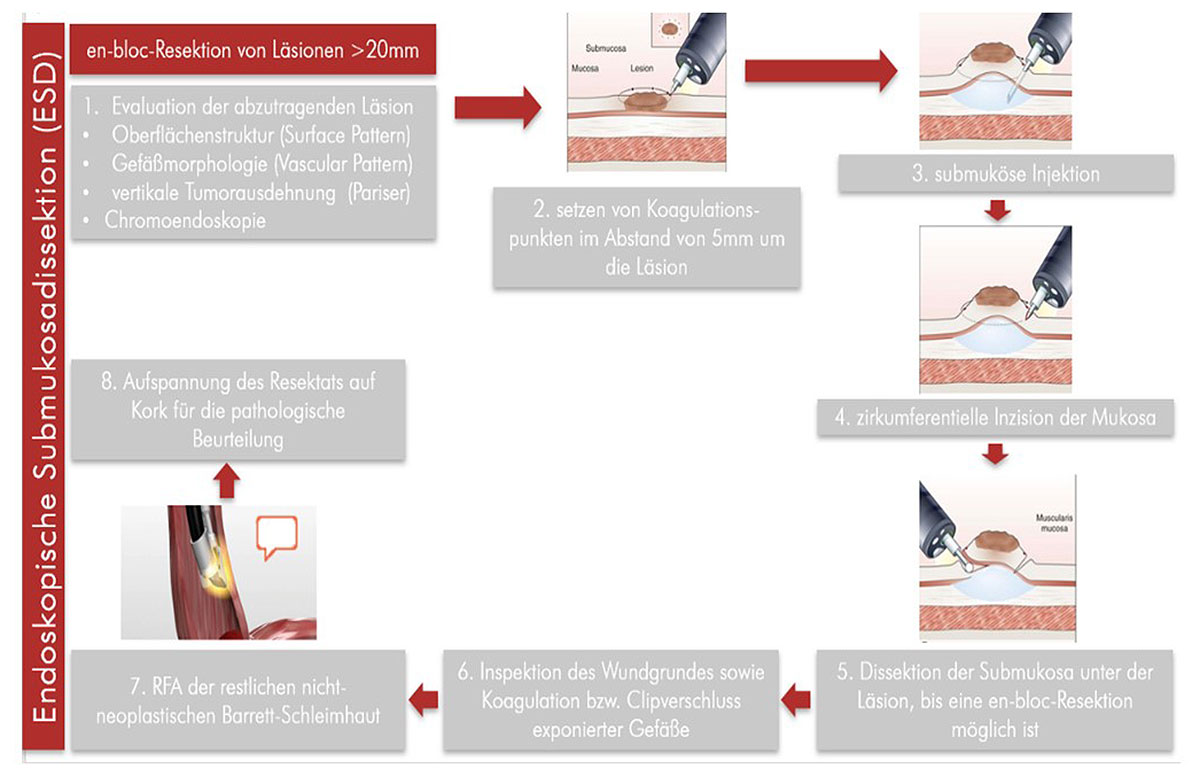
Zudem sollte eine Entfernung (Ablation) der verbliebenen, nicht-dysplastischen Barrett-Schleimhaut nach erfolgter Resektion des Frühkarzinoms, z.B. durch lokale (endoskopische) Radiofrequenz-Therapie, erfolgen. In Rahmen dieser wird mit Hilfe des Endoskops ein Elektro-Ballon eingeführt, mit welchem anschließend die Barrett-Schleimhaut mittels hochfrequenter Radiowellen durch eine kontrollierte Wärmebehandlung verödet wird (54). Dabei werden die darunter liegenden Gewebeschichten nicht geschädigt, so dass gesunde Zellen nachwachsen können (55). Dies kann zu einer deutlichen Reduktion des Rezidivrisikos beitragen (56), da die Rezividrate nach alleiniger endoskopischer Resektion bei rund 15 % liegt (57, 58). In einer Studie (59) zeigte sich, dass bei Patienten, die nur die endoskopische Resektion erhielten, sogar in 37% der Fälle ein Rezidiv auftrat, während dies nur bei 2% der Patienten mit zusätzlicher, nachgeschalteter thermischer Zerstörung (RFA) der Fall war. Damit konnte klar belegt werden, dass die Radiofrequenzablation zu einer signifikant höheren Rezidiv-Freiheit führt (60).
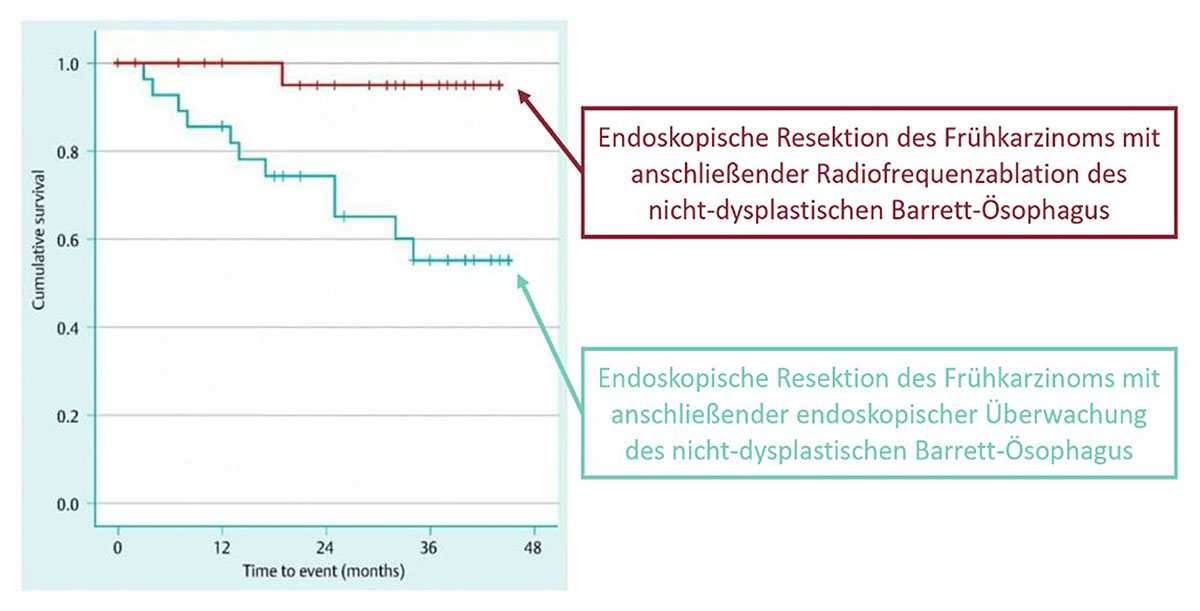
Abb. 22: Vergleich des Gesamtüberlebens nach erfolgter endoskopischer Therapie mit (rot) anschließender thermischer Zerstörung des nicht-tumorösen Barrett-Gewebes und ohne (grün).
Quelle des Diagramms: modifiziert nach Manner H, Rabenstein T, Pech O, Braun K, May A, Pohl J, Behrens A, Vieth M, Ell C. Ablation of residual Barrett's epithelium after endoscopic resection: a randomized long-term follow-up study of argon plasma coagulation vs surveillance (APE study). Endoscopy. 2014 Jan;46(1):6-12. doi: 10.1055/s-0033-1358813. Epub 2013 Dec 18. PMID: 24353120.
In einigen Fällen muss auch beim Frühkarzinom der Speiseröhre eine chirurgische Resektion einer endoskopischen Therapie vorgezogen werden (61). Aktuell wird dies bei einem Tumorrest am basalen (unteren) Resektionsrand (R1 basal), multifokalen (an vielen Orten auftretend ohne engen räumlichen Zusammenhang) und nicht-abtragbaren Barrett-Läsionen so gehandhabt (62). Nach der Resektion (chirurgisch oder endoskopisch) erfolgt die genaue mikroskopische Begutachtung des Tumors unter dem Mikroskop, um wichtige Parameter (Invasionstiefe (T), Einbruch in Blut- (V) und/oder Lymphgefäße (L), Infiltration von Perineuralscheiden (Pn), Differenzierungsgrad (G)) zu bestimmen. Ergibt diese Untersuchung nach erfolgtem endoskopischem Therapieversuch, dass der Tumor doch in tiefere Schichten der Submukosa vorgedrungen ist, sollte im zweiten Schritt eine chirurgische Resektion mit systematischer Lymphknotenentfernung und Rekonstruktion mittels Speiseröhrenersatz durch Magenhochzug erfolgen (63). Dies trifft ebenfalls zu, wenn eine Lymph- oder Gefäßinvasion (L1, V1), ein Differenzierungsgrad G3 (undifferenzierte Zellen, d.h. das Tumorgewebe weicht unter dem Mikroskop deutlich vom Ursprungsgewebe ab) oder eine tiefe Submukosainfiltration (> 500 µm) vorliegt (64).
Unter einem lokal begrenzten Barrett-Karzinom versteht man einen Tumor, der relativ oberflächlich in der Schicht unterhalb der Schleimhaut der Speiseröhre wächst (T1b, submukosales Karzinom) oder in die Muskelschicht eindringt (T2) (65). In diesen Stadien und bei fehlenden Lymphknoten- (N0) bzw. Fern-Metastasen (M0) stellt die alleinige chirurgische Entfernung des Tumors samt zugehöriger Lymphknotenstationen die Methode der Wahl dar. In randomisierten Studien konnte gezeigt werden, dass bei Patienten mit T2-Tumoren der Einsatz einer perioperativen Chemotherapie (Chemotherapie vor und nach der Operation) oder einer präoperativen Radiochemotherapie (Kombination von Bestrahlung und Chemotherapie vor einer Operation) zu keinem relevanten Überlebensvorteil führt (66). Ziel ist die vollständige Entfernung des Tumors und der dazugehörigen Lymphknoten, sodass ein Sicherheitsabstand nach proximal (nach oben) und distal (nach unten) von je 3–4 cm eingehalten wird, um eine mögliche R1-Situation (Entfernung nicht im Gesunden, d.h. tumorbefallene Resektionsränder) zu verhindern (67). Das Standardverfahren beim Barrett-Karzinom ist die transthorakale subtotale Ösophagektomie mit Schlauchmagenhochzug und hoch-intrathorakaler Anastomose. Um die vielen Fachworte in diesem Satz verstehen zu können, lohnt es sich, einen Blick auf die einzelnen Operationsschritte zu werfen:
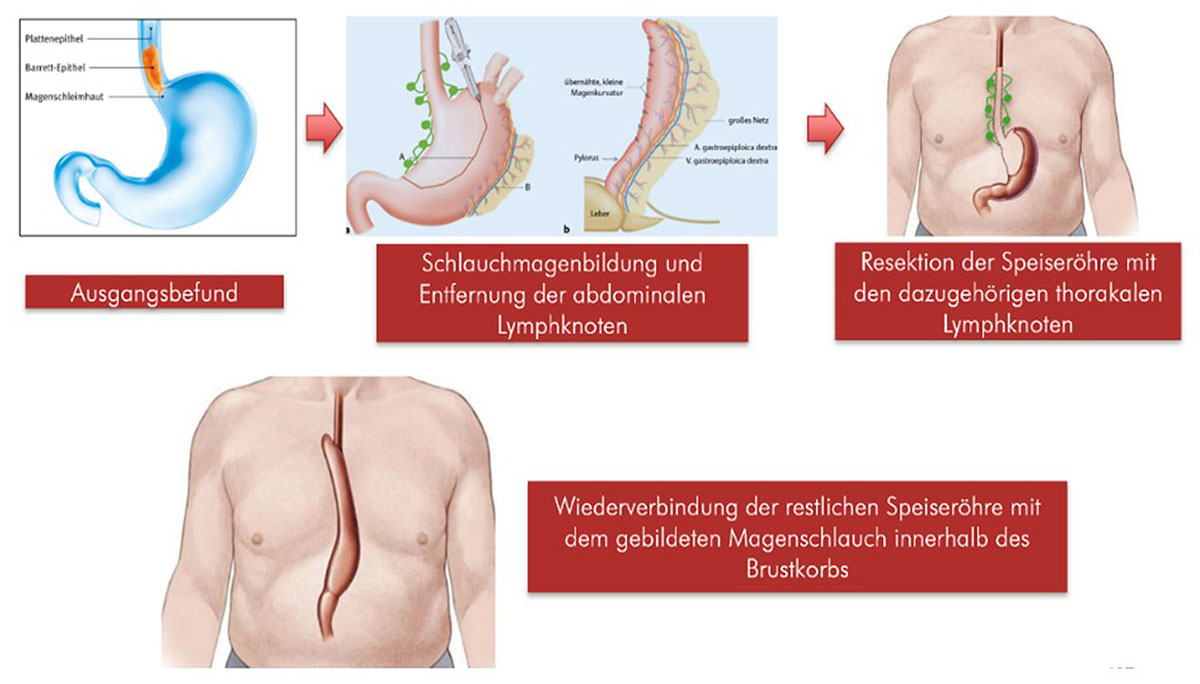
Die Lymphknoten der Speiseröhre werden in 3 Felder eingeteilt: das zervikale (im Hals), das thorakale (im Brustkorb) und das abdominale Feld (unterhalb des Zwerchfells im gesamten Oberbauch, insbesondere um den Magen) (68). Da die Zweifeld-Lymphadenektomie die Methode der Wahl ist, wird beim Barrett-Karzinom das thorakale und abdominale Lymphknoten-Feld mitreseziert (69). Im Verlauf der Zeit haben sich auch die chirurgischen Methoden weiterentwickelt, so dass die minimal-invasive Chirurgie (Schlüssellochtechnik) einen immer größeren Stellenwert in der operativen Therapie des Barrett-Karzinoms einnimmt. Dabei hat sich gezeigt, dass diese, wie auch die robotische (Teil-)Entfernung der Speiseröhre im Vergleich zur offenen Ösophagektomie eine geringere perioperative Morbidität bei gleichwertiger onkologischer Radikalität und Lebensqualität aufweist (70).
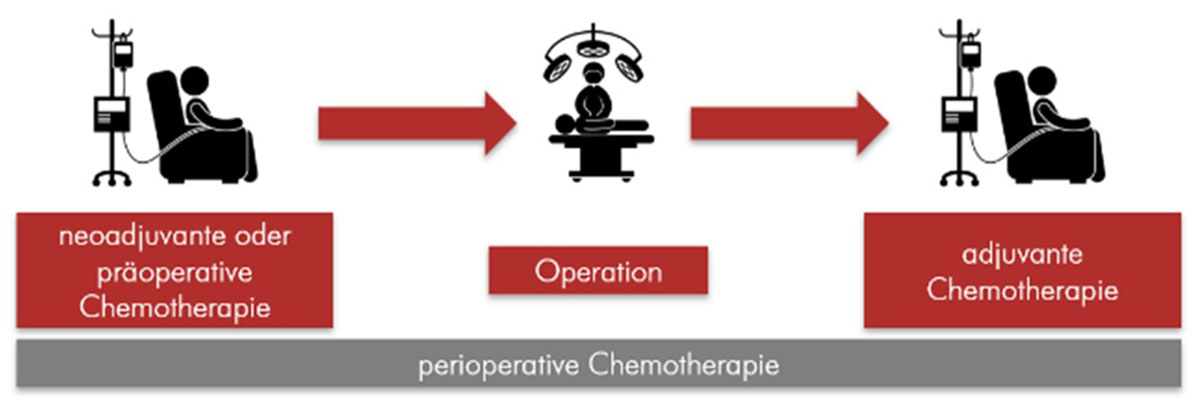
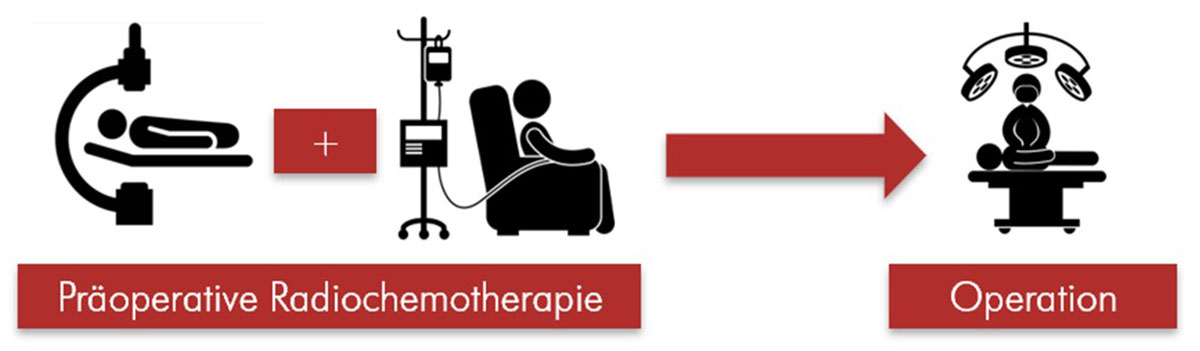
Ist der Tumor in tiefere Schichten als o.g. eingewachsen oder liegt ein Befall von Lymphknoten vor, ohne dass Fernmetastasen in anderen Organen nachweisbar sind, wird eine neoadjuvante (also vor der Operation stattfindende) oder perioperative (vor und nach der OP) Chemotherapie notwendig. Die Leitlinie empfiehlt daher ab einer Infiltration der Tunica muscularis (3. Schicht, T3) einen multimodalen Therapieansatz, das heißt die Kombination verschiedener Therapieoptionen (z.B. Chemotherapie und/ oder Radiochemotherapie mit kombinierter operativer Therapie) (71). Die Ziele der präoperativen Therapie umfassen dabei die Verbesserung der chirurgischen Resektabilität und die Verkleinerung des Tumors („Down-Sizing“). Prinzipiell stehen dafür folgende Möglichkeiten zur Verfügung:
Auch hier steht vor der Therapie zunächst immer die Diskussion aller Befunde durch die Experten im multidisziplinären Tumorboard. Auch einzelne Metastasen können heutzutage durch moderne OP-Methoden technisch sicher und kurativ entfernt werden. Da es sich in diesem fortgeschrittenen Tumorstadium aber häufig bereits um eine Systemerkrankung handelt, spielt die Chirurgie eine eher untergeordnete Rolle und muss im Einzelfall gut abgewogen werden. Im Rahmen therapeutischer Maßnahmen zielt eine System-Therapie primär darauf ab, eine Symptomlinderung und eine Verbesserung der Lebensqualität des Patienten zu erreichen. Häufig kann das Tumorzellwachstum auch „eingedämmt“ werden und es erfolgt ein Stillstand der Zellvermehrung durch spezifische Medikamente. Leider aber ist eine Heilung in dieser Situation der Metastasierung nicht möglich und die Therapiekonzepte sind palliativ. Folgende Möglichkeiten stehen im Rahmen dieser zur Verfügung:
Im Vordergrund der Nachsorge sollen regelmäßige klinische Kontrollen und die Behandlung Therapie-bedingter Beschwerden stehen (79). Je nach individuellem Risikoprofil der Patienten werden regelmäßige endoskopische und bildgebende Untersuchungen durch den Hausarzt oder Onkologen erwogen und abgestimmt (80). In diesem Rahmen sollen symptom-orientierte Untersuchungen zur Anwendung kommen. In vergangenen und laufenden Studien hat sich das Schema aus der folgenden Tabelle für die strukturierte Verlaufskontrolle und Nachsorge bei kurativer Therapie etabliert (x):
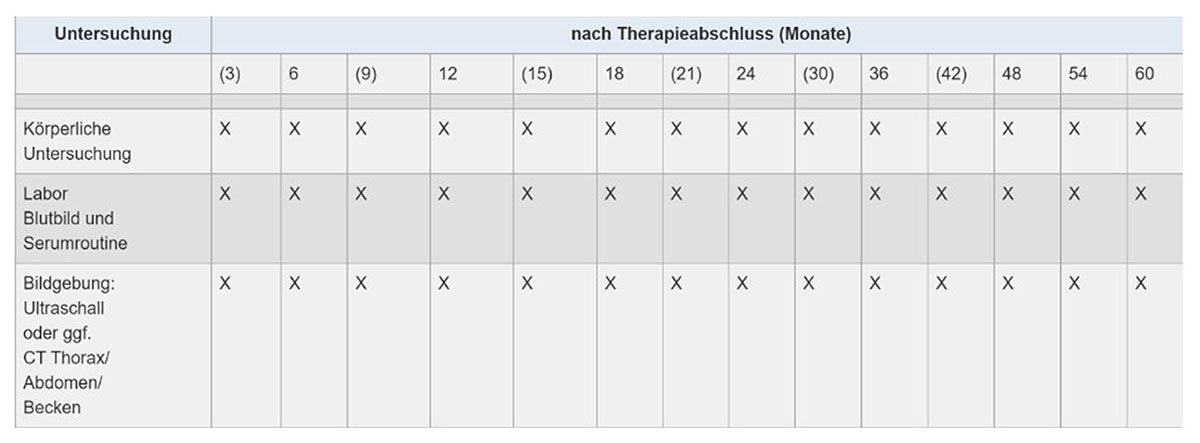 Abb. 27: Übersicht über die Zeitpunkte und den Inhalt der Nachsorgeuntersuchungen nach erfolgter Therapie beim Barrett-Karzinom.
Abb. 27: Übersicht über die Zeitpunkte und den Inhalt der Nachsorgeuntersuchungen nach erfolgter Therapie beim Barrett-Karzinom.
Quelle der Tabelle: https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html#ID0EVIAG
1 Mohy-Ud-Din N, Krill TS, Shah AR, Chatila AT, Singh S, Bilal M, Parupudi S. Barrett's esophagus: What do we need to know? Dis Mon. 2020 Jan;66(1):100850. doi: 10.1016/j.disamonth.2019.02.003. Epub 2019 Feb 23. PMID: 30808502.
2 Mohy-Ud-Din N, Krill TS, Shah AR, Chatila AT, Singh S, Bilal M, Parupudi S. Barrett's esophagus: What do we need to know? Dis Mon. 2020 Jan;66(1):100850. doi: 10.1016/j.disamonth.2019.02.003. Epub 2019 Feb 23. PMID: 30808502.
3 Mohy-Ud-Din N, Krill TS, Shah AR, Chatila AT, Singh S, Bilal M, Parupudi S. Barrett's esophagus: What do we need to know? Dis Mon. 2020 Jan;66(1):100850. doi: 10.1016/j.disamonth.2019.02.003. Epub 2019 Feb 23. PMID: 30808502.
4 Naini BV, Souza RF, Odze RD. Barrett's Esophagus: A Comprehensive and Contemporary Review for Pathologists. Am J Surg Pathol. 2016 May;40(5):e45-66. doi: 10.1097/PAS.0000000000000598. PMID: 26813745; PMCID: PMC4833583.
5 https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/krebsarten/weitere-krebsarten/speiseroehrenkrebs/definition-und-haeufigkeit.html
6 https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/krebsarten/weitere-krebsarten/speiseroehrenkrebs/definition-und-haeufigkeit.html
7 https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/krebsarten/weitere-krebsarten/speiseroehrenkrebs/definition-und-haeufigkeit.html
8 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
9 Russo A, Bronte G, Cabibi D, Bazan V, Cicero G, Bertani A, Rizzo S, Fiorentino E. The molecular changes driving the carcinogenesis in Barrett's esophagus: which came first, the chicken or the egg? Crit Rev Oncol Hematol. 2013 Jun;86(3):278-89. doi: 10.1016/j.critrevonc.2012.12.001. Epub 2013 Jan 4. PMID: 23290822.
10 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
11 Russo A, Bronte G, Cabibi D, Bazan V, Cicero G, Bertani A, Rizzo S, Fiorentino E. The molecular changes driving the carcinogenesis in Barrett's esophagus: which came first, the chicken or the egg? Crit Rev Oncol Hematol. 2013 Jun;86(3):278-89. doi: 10.1016/j.critrevonc.2012.12.001. Epub 2013 Jan 4. PMID: 23290822.
12 Kuipers EJ, Spaander MC. Natural History of Barrett's Esophagus. Dig Dis Sci. 2018 Aug;63(8):1997-2004. doi: 10.1007/s10620-018-5161-x. PMID: 29905908; PMCID: PMC6113676.
13 Chang P, Friedenberg F. Obesity and GERD. Gastroenterol Clin North Am. 2014 Mar;43(1):161-73. doi: 10.1016/j.gtc.2013.11.009. Epub 2013 Dec 27. PMID: 24503366; PMCID: PMC3920303.
14 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
15 van Blankenstein M, Looman CW, Johnston BJ, Caygill CP. Age and sex distribution of the prevalence of Barrett's esophagus found in a primary referral endoscopy center. Am J Gastroenterol. 2005 Mar;100(3):568-76. doi: 10.1111/j.1572-0241.2005.40187.x. PMID: 15743353.
16 Russo A, Bronte G, Cabibi D, Bazan V, Cicero G, Bertani A, Rizzo S, Fiorentino E. The molecular changes driving the carcinogenesis in Barrett's esophagus: which came first, the chicken or the egg? Crit Rev Oncol Hematol. 2013 Jun;86(3):278-89. doi: 10.1016/j.critrevonc.2012.12.001. Epub 2013 Jan 4. PMID: 23290822.
17 Kuipers EJ, Spaander MC. Natural History of Barrett's Esophagus. Dig Dis Sci. 2018 Aug;63(8):1997-2004. doi: 10.1007/s10620-018-5161-x. PMID: 29905908; PMCID: PMC6113676.
18 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
19 Solaymani-Dodaran M, Logan RF, West J, Card T, Coupland C. Risk of oesophageal cancer in Barrett's oesophagus and gastro-oesophageal reflux. Gut. 2004 Aug;53(8):1070-4. doi: 10.1136/gut.2003.028076. PMID: 15247170; PMCID: PMC1774141.
20 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
21 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
22 https://refubium.fu-berlin.de/bitstream/handle/fub188/10338/kap1.pdf?sequence=2&isAllowed=y
23 https://refubium.fu-berlin.de/bitstream/handle/fub188/10338/kap1.pdf?sequence=2&isAllowed=y
24 Russo A, Bronte G, Cabibi D, Bazan V, Cicero G, Bertani A, Rizzo S, Fiorentino E. The molecular changes driving the carcinogenesis in Barrett's esophagus: which came first, the chicken or the egg? Crit Rev Oncol Hematol. 2013 Jun;86(3):278-89. doi: 10.1016/j.critrevonc.2012.12.001. Epub 2013 Jan 4. PMID: 23290822.
25 https://refubium.fu-berlin.de/bitstream/handle/fub188/10338/kap1.pdf?sequence=2&isAllowed=y
26 Russo A, Bronte G, Cabibi D, Bazan V, Cicero G, Bertani A, Rizzo S, Fiorentino E. The molecular changes driving the carcinogenesis in Barrett's esophagus: which came first, the chicken or the egg? Crit Rev Oncol Hematol. 2013 Jun;86(3):278-89. doi: 10.1016/j.critrevonc.2012.12.001. Epub 2013 Jan 4. PMID: 23290822.
27 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
28 https://www.quora.com/What-is-the-difference-between-adventitia-and-serosa
29 https://www.quora.com/What-is-the-difference-between-adventitia-and-serosa
30 Encinas de la Iglesia J, Corral de la Calle MA, Fernández Pérez GC, Ruano Pérez R, Álvarez Delgado A. Esophageal cancer: anatomic particularities, staging, and imaging techniques. Radiologia. 2016 Sep-Oct;58(5):352-65. English, Spanish. doi: 10.1016/j.rx.2016.06.004. Epub 2016 Jul 25. PMID: 27469407.
31 Oetzmann von Sochaczewski C, Haist T, Pauthner M, Mann M, Braun S, Ell C, Lorenz D. Infiltration Depth is the Most Relevant Risk Factor for Overall Metastases in Early Esophageal Adenocarcinoma. World J Surg. 2020 Apr;44(4):1192-1199. doi: 10.1007/s00268-019-05291-6. PMID: 31853591.
32 Oetzmann von Sochaczewski C, Haist T, Pauthner M, Mann M, Braun S, Ell C, Lorenz D. Infiltration Depth is the Most Relevant Risk Factor for Overall Metastases in Early Esophageal Adenocarcinoma. World J Surg. 2020 Apr;44(4):1192-1199. doi: 10.1007/s00268-019-05291-6. PMID: 31853591.
33 Pennathur A, Gibson MK, Jobe BA, Luketich JD. Oesophageal carcinoma. Lancet. 2013 Feb 2;381(9864):400-12. doi: 10.1016/S0140-6736(12)60643-6. PMID: 23374478.
34 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
35 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
36 Dam AN, Klapman J. A narrative review of Barrett's esophagus in 2020, molecular and clinical update. Ann Transl Med. 2020 Sep;8(17):1107. doi: 10.21037/atm-20-4406. PMID: 33145326; PMCID: PMC7575938.
37 Dam AN, Klapman J. A narrative review of Barrett's esophagus in 2020, molecular and clinical update. Ann Transl Med. 2020 Sep;8(17):1107. doi: 10.21037/atm-20-4406. PMID: 33145326; PMCID: PMC7575938.
38 Dam AN, Klapman J. A narrative review of Barrett's esophagus in 2020, molecular and clinical update. Ann Transl Med. 2020 Sep;8(17):1107. doi: 10.21037/atm-20-4406. PMID: 33145326; PMCID: PMC7575938.
39 https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/basis-informationen-krebs-allgemeine-informationen/klassifikation-von-tumoren-tnm-.html
40 https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/basis-informationen-krebs-allgemeine-informationen/klassifikation-von-tumoren-tnm-.html
41 https://www.kenhub.com/de/library/anatomie/histologie-osophagus
42 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
43 https://www.gesundheitsinformation.de/krebs-was-bedeuten-die-kuerzel-im-arztbrief.html
44 https://de.wikipedia.org/wiki/Stadienbestimmung_(Onkologie)
45 https://link.springer.com/content/pdf/10.1007%2F3-540-31303-6_27.pdf
46 https://healthcare-in-europe.com/de/news/die-tumorkonferenz-alle-fuer-einen.html
47 https://healthcare-in-europe.com/de/news/die-tumorkonferenz-alle-fuer-einen.html
48 https://www.karger.com/Article/PDF/327737
49 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
50 https://www.karger.com/Article/PDF/327737
51 https://www.karger.com/Article/PDF/327737
52 https://www.thieme-connect.com/products/ejournals/pdf/10.1055/s-0044-100308.pdf
53 https://www.thieme-connect.com/products/ejournals/pdf/10.1055/s-0044-100308.pdf
54 https://www.vivantes.de/klinikum-spandau/fachbereiche/kliniken/innere-medizin-gastroenterologie/medizinische-angebote/radiofrequenzablation
55 https://www.vivantes.de/klinikum-spandau/fachbereiche/kliniken/innere-medizin-gastroenterologie/medizinische-angebote/radiofrequenzablation
56 https://www.karger.com/Article/PDF/327737
57 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
58 Pech O, May A, Manner H, Behrens A, Pohl J, Weferling M, Hartmann U, Manner N, Huijsmans J, Gossner L, Rabenstein T, Vieth M, Stolte M, Ell C. Long-term efficacy and safety of endoscopic resection for patients with mucosal adenocarcinoma of the esophagus. Gastroenterology. 2014 Mar;146(3):652-660.e1. doi: 10.1053/j.gastro.2013.11.006. Epub 2013 Nov 20. PMID: 24269290.
59 Manner H, Rabenstein T, Pech O, Braun K, May A, Pohl J, Behrens A, Vieth M, Ell C. Ablation of residual Barrett's epithelium after endoscopic resection: a randomized long-term follow-up study of argon plasma coagulation vs. surveillance (APE study). Endoscopy. 2014 Jan;46(1):6-12. doi: 10.1055/s-0033-1358813. Epub 2013 Dec 18. PMID: 24353120.
60 Manner H, Rabenstein T, Pech O, Braun K, May A, Pohl J, Behrens A, Vieth M, Ell C. Ablation of residual Barrett's epithelium after endoscopic resection: a randomized long-term follow-up study of argon plasma coagulation vs. surveillance (APE study). Endoscopy. 2014 Jan;46(1):6-12. doi: 10.1055/s-0033-1358813. Epub 2013 Dec 18. PMID: 24353120.
61 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
62 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
63 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
64 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html
65 https://www.krebsinformationsdienst.de/tumorarten/speiseroehrenkrebs/behandlung.php
66 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html#litID0ESFAI
67 https://www.amboss.com/de/wissen/%C3%96sophaguskarzinom/
68 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html#litID0ESFAI
69 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html#litID0ESFAI
70 Mann C, Berlth F, Hadzijusufovic E, Lang H, Grimminger PP. Minimally invasive esophagectomy: clinical evidence and surgical techniques. Langenbecks Arch Surg. 2020 Dec;405(8):1061-1067. doi: 10.1007/s00423-020-02003-w. Epub 2020 Oct 7. PMID: 33026466; PMCID: PMC7686170.
71 S3-Leitlinie Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus
72 https://www.gelbe-liste.de/krankheiten/oesophaguskarzinom
73 https://www.gelbe-liste.de/krankheiten/oesophaguskarzinom
74 https://www.amboss.com/de/wissen/%C3%96sophaguskarzinom/
75 onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html#litID0E44BG
76 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
77 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
78 https://www.aerzteblatt.de/archiv/168936/Epidemiologie-Diagnostik-und-Therapie-des-Barrett-Karzinoms
79 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html#ID0EVIAG
80 https://www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@guideline/html/index.html#ID0EVIAG